Счетчики
Полоний (Po).
Торий (Th).
Нептуний (Np).
Америций (Am).
Калифорний (Cf).
Полоний (Po)
Полоний - металл легкоплавкий и сравнительно низкокипящий; температуры его плавления и кипения соответственно 254 и 962 °С.
Чистый полоний - металл серебристо-белого цвета - существует в двух аллотропных модификациях. Кристаллы одной из них - низкотемпературной - имеют кубическую решетку, а другой - высокотемпературной - ромбическую. Фазовый переход из одной формы в другую происходит при 36 °С, однако при комнатной температуре полоний находится в высокотемпературной форме. Его подогревает собственное излучение.
По внешнему виду полоний похож на любой самый обыкновенный металл. По легкоплавкости - на свинец и висмут. По электрохимическим свойствам - на благородные металлы. По оптическому и рентгеновскому спектрам - только на самого себя. А по поведению в растворах - на все другие радиоактивные элементы: благодаря ионизирующему излучению в растворах, содержащий полоний, постоянно образуются и разлагаются озон и перекись водорода.
По химическим свойствам полоний - прямой аналог серы, селена и теллура. Он проявляет валентности 2-, 2+, 4+, 6+, что естественно для элемента этой группы. Известны и достаточно хорошо изучены многочисленные соединения полония, начиная от простого окисла PoO2, растворимого в воде, и кончая сложными комплексными соединениями. Его плотность - 9.4 - чуть меньше, чем у свинца.
Все радиоактивные элементы и изотопы, как известно, объединяются в семейства: распадаясь, ядро радиоактивного атома превращается в атомное ядро другого, дочернего элемента. Все элементы радиоактивных семейств находятся между собой в определенном равновесии. В урановых рудах равновесное отношение урана к полонию составляет 1.9x1010. Это означает, что в урановых минералах полония почти в двадцать миллиардов раз меньше, чем урана. Получить его из руды действительно сложно, но есть другой путь - синтез.
Сегодня полоний получают двумя способами, причем исходным сырьем в обоих случаях висмут-209. В атомных реакторах его облучают потоками нейтронов, и тогда по сравнительно несложной цепочке ядерных превращений образуется самый важный сегодня изотоп - полоний-210:
Bi209 + n -> Bi210 -> Po210.
А если тот же изотоп висмута поместить в другую важнейшую машину ядерного синтеза - циклотрон и там обстрелять потоками протонов, то по реакции
Bi209 + p -> Po209 + n
образуется самый долгоживущий изотоп полония.
Первая реакция важнее: полоний-210 гораздо более интересный для техники изотоп, чем полоний-209. К тому же по второй реакции одновременно образуется свинец-209 - одна из самых трудноудаляемых примесей к полонию.
При работе с полонием приходится соблюдать особую осторожность. Пожалуй, это один из самых опасных радиоэлементов. Его активность настолько велика, что, хотя он излучает только альфа-частицы, брать его руками нельзя, результатом будет лучевое поражение кожи и, возможно, всего организма: полоний довольно легко проникает внутрь сквозь кожные покровы. Элемент №84 опасен и на расстоянии, превышающим длину пробега альфа-частиц. Он способен быстро переходить в аэрозольное состояние и заражать воздух. Поэтому работают с полонием лишь в герметичных боксах.
Всего известны 27 изотопов полония с массовыми числами от 192 до 218. Это один из самых многоизотопных, если можно так выразиться, элементов. Период полураспада самого долгоживущего изотопа - полония-209 - 103 года. Поэтому, естественно, в земной коре есть только радиогенный полоний, и его там исключительно мало - 2x10-14%. Наиболее важный изотоп полоний-210 - чистый альфа-излучатель. Испускаемые им частицы тормозятся в металле и, пробегая в нем всего несколько микрон, растрачивают при этом свою энергию. Энергия альфа-частиц полония превращается в тепло, которое можно использовать, скажем, для обогрева и которое не так уж сложно превратить в электричество.
Эту энергию уже используют и на Земле, и в космосе. Изотоп Po210 применен в энергетических установках некоторых искусственных спутников. Чистые альфа-излучатели, и полоний-210 в первую очередь, имеют перед другими источниками излучения несколько очевидных преимуществ. Во-первых, альфа-частица достаточно массивна и, следовательно, несет много энергии. Во-вторых, такие излучатели практически не требуют специальных мер защиты: проникающая способность и длина пробега альфа-частицы минимальны.
В принципе для работы на космических станциях в качестве источников энергии приемлимы плутоний-238, полоний-210, стронций-90, церий-144 и кюрий-244. Но у полония-210 есть важное преимущество перед остальными изотопами-конкурентами - самая высокая удельная мощность, 1210 вт/см3. Он выделяет так много тепловой энергии, что это тепло способно расплавить образец. Чтобы этого не случилось, полоний помещают в свинцовую матрицу. Образующийся сплав полония и свинца имеет температуру плавления около 600 °С - намного больше, чем у каждого из составляющих металлов. Мощность, правда, при этом уменьшается, но она остается достаточно большой - около 150 вт/см3.
Радиоактивный изотоп полоний-210 служил топливом "печки", установленной на "Луноходе-2". Лунные ночи очень долги и холодны. В течении 14.5 земных суток луноход находился при температуре ниже -130 °С. Но в приборном контейнере все это время должна была сохраняться температура, приемлемая для научной аппаратуры.
Полониевый источник тепла был размещен вне приборного контейнера. Полоний излучал тепло непрерывно; но только тогда, когда температура в приборном отсеке опускалась ниже необходимого предела, газ-теплоноситель, подогреваемый полонием, начинал поступать в контейнер. В остальное время избыточное тепло рассеивалось в космическое пространство.
Есть, правда, у полония-210 и ограничение. Относительно малый период его полураспада - всего 138 дней - ставит естественный предел срока службы радиоизотопных источников с полонием.
Подобные же устройства работают и на земле. Кроме них важны полоний-бериллиевые и полоний-борные источники нейтронов. Это герметичные металлические ампулы, в которые заключена покрытая полонием-210 керамическая таблетка из карбида бора или карбида бериллия. Поток нейтронов из ядер атома бора или бериллия порождают альфа-частицы, испускаемые полонием.
Такие нейтронные источники легки и портативны, совершенно безопасны в работе и очень надежны. Латунная ампула диаметром два и высотой четыре сантиметра ежесекундно дает до 90 миллионов нейтронов.
Торий (Th)
Выдающегося шведского ученого Йенса Якоба Берцелиуса справедливо называли некоронованным королем химиков первой половины XIX столетия. Человек энциклопедических знаний и превосходный аналитик, Берцелиус работал очень плодотворно и почти никогда не ошибался. В его лаборатории были определены атомные веса большинства известных тогда элементов (около 50), выделены в свободном состоянии церий и кальций, стронций и барий, кремний и цирконий, открыты селен и торий.
В 1815 году, анализируя редкий минерал, найденный в округе Фалюн (Швеция), Берцелиус обнаружил в нем окись нового элемента. Этот элемент был назван торием в честь всемогущего скандинавского божества Тора.
Прошло десять лет, прежде чем Берцелиус обнаружил ошибку: вещество, которое он считал окисью тория, на самом деле оказалось фосфатом уже известного иттрия.
Еще через три года, в 1828 году, Берцелиусу прислали еще один редкий минерал, который теперь называют торитом (ThSiO4). Торит содержит до 77% окиси тория ThO2. Обнаружить столь явный компонент Берцелиусу не составило особого труда. Исследовав выделенную землю, Берцелиус убедился, что это окись нового элемента, к которому и перешло название "торий".
Получить чистый металлический торий Берцелиусу не удалось. Правда, он восстановил калием фтористые соединения нового элемента и получил серый металлический порошок, сильно загрязненный примесями. Чистый препарат тория был получен лишь в 1882 году другим известным шведским химиком - первооткрывателем скандия Ларсом Фредериком Нильсоном.
Радиоактивность тория была открыта в 1898 году независимо друг от друга и практически одновременно Марией Склодовская-Кюри и Гербертом Шмидтом.
Торий - серебристо-белый блестящий металл, стойкий к окислению в чистом виде, но обычно медленно тускнеющий до темного цвета с течением времени. Торий медленно разрушается водой, но плохо растворяется в основных кислотах, за исключением соляной. Он малорастворим в серной и азотной кислотах. Порошок металлического тория пирофорен поэтому обращаться с ним нужно с осторожностью. При нагреве в воздухе он загорается и горит ярким белым светом. Чистый торий - мягкий, очень гибкий и ковкий, с ним можно работать непосредственно (холодный прокат, горячая штамповка и т.п.), однако его протяжка затруднительна из-за низкого предела прочности на разрыв. Содержание оксида сильно затрагивает механические свойства тория; даже чистые образцы тория обычно содержат несколько десятых процента оксида тория. При сильном нагреве он взаимодействует с галогенами, серой и азотом.
Основные свойства тория:
плотность: 11.72
температура плавления: 1750 C
температура кипения: 4790 C
Окись тория является довольно тугоплавкой субстанцией - ее температура плавления 3300 °С - самая высокая из всех оксидов и выше большинства других материалов, за несколькими исключениями. Это свойство когда-то рассматривалось для основного коммерческого использования тория как огнеупорной керамики - в основном в керамических деталях, огнеупорных литьевых формах и тиглях. Но, выдерживая высочайшие температуры, окись тория частично растворяется во многих жидких металлах и загрязняет их. Самое широкое применение окиси было в производстве газокалильных сеток для газовых фонарей.
Сейчас торий используется для добавки в многокомпонентные сплавы на основе магния. Торий заметно повышает прочность и жаростойкость этих легких сплавов. Так же торий применяется и как катализатор - в процессах органического синтеза и крекинга нефти и при синтезе жидкого топлива из каменного угля.
Элементом особой важности, стратегическим металлом торий стал лишь после второй мировой войны.
Как и всякий четно-четный изотоп (четное число протонов и нейтронов), торий-232 не способен делиться тепловыми нейтронами. Но под действием тех же нейтронов с торием происходит вот что:
Th232 + n -> Th233 -> Pa233 -> U233
А U233 - отличное ядерное горючее, поддерживающее цепное деление и имеющее некоторое преимущество: при делении его ядер выделяется больше нейтронов. Каждый нейтрон, поглощенный ядром плутония-239 или урана-235, дает 2.03-2.08 новых нейтронов, а уран-233 - намного больше - 2.37.
Применение тория в качестве ядерного горючего затруднено прежде всего тем, что в побочных реакциях образуются изотопы с высокой активностью. Главный из таких загрязнителей - уран-232 - альфа- и гамма-излучатель с периодом полураспада 73.6 года. Его использованию препятствует и то обстоятельство, что торий дороже урана. Уран легче выделить. Некоторые урановые минералы (уранит, урановая смолка) - это простые окислы урана. У тория таких. простых минералов (имеющих промышленное значение) нет. А попутное выделение из редкоземельных минералов осложнено сходством тория с элементами семейства лантана.
Главная проблема получения делящегося материала из тория состоит в том, что он изначально не присутствует в реальном реакторном топливе, в отличие от U-238. Для использования ториевого воспроизводства высокообогащенный делящийся материал (U-235, U-233, Pu-239) должен использоваться в качестве топлива реактора с включениями тория по большей части только для возможности воспроизводства (т.е. не происходит или происходит незначительное выделение энергии, хотя сгорание U-233, полученного на месте, может внести вклад в выделение энергии). С другой стороны, тепловые бридерные реакторы (на медленных нейтронов) способны использовать U-233/торий цикл воспроизводства, особенно если в качестве замедлителя использовать тяжелую воду.
В 1997 году базисная цена на оксид тория составляла 65.55$ за килограмм, 82.50$ за 99.9% чистоту и 107.25$ за килограмм металлического тория 99.99% чистоты.
Производство тория. Уже упоминавшийся минерал торит очень богат торием, но редок, так же как и другой богатый ториевый минерал - торианит (Th, U)O2, содержащий от 45 до 93% ThO2.
Однако еще в конце XIX века при участии Ауэра фон Вельсбаха на Атлантическом побережье Бразилии были начаты разработки монацитовых песков. В общем виде формулу этого минерала обычно пишут так: (Ce, Th)PO4, но он содержит кроме церия еще и лантан, и празеодим, и неодим и другие редкие земли. А кроме тория - уран.
Тория в монаците, как правило, содержится от 2.5 до 12%. Богатые монацитовые россыпи помимо Бразилии есть в Индии, США, Австралии, Малайзии. Известны и жильные месторождения этого минерала - на юге Африки.
Считать торий очень уж редким металлом было бы неправильно. В земной коре его 8x10-4%, примерно столько же, сколько свинца. Но ториевое сырье - это всегда сырье комплексное.
Известны 12 изотопов, однако природный торий состоит целиком из одного изотопа - Th-232. Период полураспада этого изотопа - 1.405x1010 лет, вид распада - альфа-распад. Его удельная радиоактивность 0.109 микрокюри/г. Распад тория приводит к образованию радиоактивного газа радон-220, который представляет опасность при вдыхании.
Пять остальных изотопов тория образуются в процессах распада U-238, U-235 и Th-232. Это Th-227 (период полураспада 18.72 дней), Th-228 (1.9116 года), Th-230 (75.380 лет), Th-231 (1.063 дня) и Th-234 (24.1 дня). Все эти изотопы, за исключением Th-228, производятся в последовательности распада урана, концентрация их в природном тории зависит от относительного содержания урана и возможного химического выщелачивания промежуточных звеньев - протактиния и актиния. Для практических применений, единственными изотопами, присутствующими в заметных количествах в очищенном тории - Th-228 и Th-230, т.к. остальные имеют очень короткий период полураспада, и Th-228 распадается после нескольких лет хранения.
Нептуний (Np)
Нептуний - первый открытый трансурановый элемент и первый очищенный искусственный трансуран. Хотя следы присутствия нептуния были найдены и в природе, он открыт Эдвином Макмилланом и Филипом Эйбельсоном в мае 1940 года в Беркли, Калифорния. В распоряжении ученых была мощная по тем временам ядерная машина - циклотрон Калифорнийского университета. Ускоренный в циклотроне пучок дейтронов падал на бериллиевую пластину. В столкновениях дейтронов с ядрами бериллия рождался сильный поток нейтронов, которые и бомбардировали урановую мишень. Ядра нового элемента Макмиллан предложил назвать Нептунием, по аналогии с солнечной системой, в которой за планетой Уран следует Нептун.
Так же как и следующий элемент, плутоний, нептуний был найден в следовых количествах в урановых рудах, где он получается благодаря захвату ураном нейтрона спонтанного деления.
Существуют три природных радиоактивных семейства - тория-232, урана-235 и урана-238. В наши дни воссоздан четвертый радиоактивный ряд - семейство нептуния-237. Помимо "искусственности" это семейство отличают еще две особенности: во-первых, в нем нет изотопов радона и, во-вторых, конечный продукт распада в этом случае не изотоп свинца, а висмут-209:
Np237 альфа-распад -> Pa233
Pa233 бета-распад -> U233
U233 альфа-распад -> Th229
Th229 альфа-распад -> Ra225
Ra225 бета-распад -> Ac225
Ac225 альфа-распад -> Fr221
Fr221 альфа-распад -> At217
At217 альфа-распад -> Bi213
Bi213 альфа-распад -> Tl209
Tl209 бета-распад -> Pb209
Bi213 бета-распад -> Po213
Po213 альфа-распад -> Pb209
Pb209 бета-распад -> Bi209.
Самый долгоживущий изотоп элемента №93 рождается в интересной ядерной реакции: быстрый нейтрон поражает ядерное ядро и захватывается им. Образовавшееся сочетание оказывается неустойчивым и в некоторых случаях разваливается на два осколка, а иногда из него вылетают один за другим два нейтрона и уносят избыток энергии. Продукт ядерной реакции - уран-237 - неустойчив: испустив бета-частицу, он переходит в нептуний-237. Np237 изотоп с малой удельной активностью, его период полураспада 2.2 миллиона лет. Благодаря этому процессу в реакторах накапливаются килограммы нептуния:
U235 + n -> U236
U236 + n -> U237
U237 -> (6.8 дней, бета) -> Np237.
Это отнюдь не бесполезные килограммы. Нептуний-237 - прекрасный стартовый материал для накопления плутония-238 - ценного топлива ядерных космических батарей и других деликатных устройств вроде стимулятора сердечной деятельности или искусственного сердца.
Хорошо изучены ядерные характеристики одиннадцати изотопов нептуния - от 231-го до 241-го. Изотопы с большими массовыми числами, вплоть до нептуния-257, образуются при взрыве водородной бомбы. Об этом свидетельствует появление в продуктах ядерного взрыва атомов фермия.
Нептуний - серебристый металл с плотностью 20.45 (Np-237, 25 °C), нептуний пятый по плотности элемент. Он имеет по крайней мере три аллотропные формы - альфа-форма самая плотная (стабильна ниже 280 °C, ромбическая, плотность 20.45 при 25 °C), бета (выше 280 °C, тетрагональная, плотность 19.36 при 313 °C) и гамма (выше 577 °C, кубическая, плотность 18.0 при 600 °C). Температура плавления - 637 °C, температура кипения оценивается в 5235 °C. Нептуний - пятый член ряда актиноидов. Он химически активен и сходен с ураном со степенями окисления от +3 до +7 (III-VII). Чистый метал получают восстановлением NpF3 парами бария или лития при температуре около 1200 °C. Разные ионы нептуния по-разному окрашивают растворы: Np3+ - в голубой или пурпурный цвет, Np4+ - в желто-зеленый, NpO2+- в голубовато-зеленый, NpO2+2 - в розовый или красный.
Нептуний-237 материал способный к цепному ядерному делению. По опубликованным оценкам критическая масса Np237 - 90 кг (диапазон оценок 75-105 кг). Он обладает очень низким уровнем спонтанного деления, менее 0.05 делений/с-кг. Высокое значение критической массы (почти удвоенное по отношению к обогащенному урану-235) и высокая стоимость производства делают его непривлекательным для оружейного использования. Определенное количество Np-237 обычно образуется из захвата нейтронов U-235. Типичный энергетический реактор способен дать около 0.4 кг Np-237 на тонну горючего. Ядерные реакторы на быстрых нейтронах могут произвести значительно большее количество.
Америций (Am)
Америций (атомный номер 95) четвертый синтезированный трансурановый элемент (кюрий, элемент №96, был открыт несколькими месяцами ранее). Он был идентифицирован Гленном Т. Сиборгом, А. Гиорсо, Р. Джеймсом и Л. Морганом в 1944 году в результате облучения изотопов плутония нейтронами в реакторе как Am-241. Амерций был так же получен Сиборгом путем бомбардировки Pu-234 альфа-частицами.
Америций - металл серебристо-белого цвета, тягучий и ковкий. Больше всего он похож на металлы редкоземельного семейства. Америций медленно тускнеет в сухом воздухе при комнатной температуре. Имеет две аллотропные формы. В низкотемпературной форме обладает двойной плотно упакованной шестиугольной структурой, плотность 13.67, которая при 1074 °С преобразуется в гранецентрированную кубическую. Температура плавления - 1175 °С.
Америций имеет валентности 2, 3, 4, 5 и 6, в водных растворах кислот со следующими катионами: Am3+, Am4+; в высших степенях окисления америций входит в состав катиона в форме кислородосодержащего "ил"-иона: (AmO2)+, если америций пятивалентен, и (AmO2)+2, если он шестивалентен. Трехвалентный америций наиболее распространен в водных растворах и его состояние очень сходно с остальными актиноидными и лантаноидными элементами. Четырехвалентный америций известен только в твердом состоянии. Америций реагирует с кислородом образуя диоксид AmO2 и с водородом образуя гидрид AmH2. Диоксид америция получается при прокаливании большинства трехвалентных составов, AmF4 производят фторированием диоксида или трифторида.
У пятивалентного америция обнаружено одно очень интересное химическое свойство - способность к диспропорционированию. Это значит, что для химического взаимодействия в кислых растворах ему не нужны партнеры-реагенты. Окислительно-восстановительная реакция идет между ионами пятивалентного америция: один из них присоединяет два электрона, облагая данью двух соседей. В системе появляется ион америция (III) и два иона америция (VI). Причиной этого необычного явлениясчитают аномальную разницу окислительно-восстановительных потенциалов пар Am (III) - Am (VI) и Am (III) - Am (V). Подобным же образом ведет себя и четырехвалентный америций.
Самый долгоживущий изотоп америция - Am243, он живет 8 000 лет и используется пока для радиохимических исследований и накопления более отдаленных трансуранов, вплоть до фермия.
Значительно многообразние применение самого первого изотопа америция - Am241. Этот изотоп, распадаясь, испускает альфа-частицы и мягкие (60 кэВ) гамма-лучи (энергия жестких гамма-квантов, испускаемых кобальтом-60 - несколько МэВ). Защита от мягкого излучения Am-241 сравнительно проста и немассивна: вполне достаточно сантиметрового слоя свинца. Am-241 имеет период полураспада 433 года. В промышленности используются различные контрольно-измерительные и исследовательские приборы с америцием-241. В частности, такими приборами пользуются для непрерывного измерения толщины стальной (от 0.5 до 3 мм) и алюминиевой (до 50 мм) ленты, а также листового стекла. Аппаратуру с америцием-241 используют и для снятия электростатических зарядов в промышленности с пластмасс, синтетических пленок и бумаги. Он находится и внутри некоторых детекторов дыма (~0.26 микрограмма на детектор).
Am-241 сейчас получают в промышленном количестве при распаде Pu-241: Pu-241 -> (13.2 года, бета) -> Am-241.
Так как Pu-241 обычно присутствует в только что выработанном оружейном плутонии, Am-241 накапливается в веществе с распадом Pu-241. В связи с этим, он играет важную роль в старении оружия. Свежеизготовленный оружейный плутоний содержит 0.5-1.0% Pu-241, реакторный плутоний имеет от 5-15% до 25% Pu-241. Через несколько десятилетий почти весь Pu-241 распадется в Am-241. Энергетика альфа-распада Am-241 и относительно короткое время жизни создают высокую удельную радиоактивность и тепловой выход. Большая часть альфа- и гамма-активности старого оружейного плутония обусловливается Am-241.
На сентябрь 1998 года цена изотопного отделения Ок-Риджской национальной лаборатории (ORNL) на америций была такова: $728 за грамм америция-241 и $180.25 за миллиграмм америция-243.
Калифорний (Cf)
В 1952 году среди новых ядер, извлеченных из продуктов термоядерного испытания Ivy Mike, был обнаружен удивительный изотоп калифорний-254. Удивительный потому, что главным видом его распада оказалось спонтанное деление. Прежде подобные ядра в таблице изотопов не встречались. У спонтанно делящихся предшественников калифорния самопроизвольное деление составляло мизерную долю от полного числа актов распада. Так, на несколько миллионов актов распада U-238 приходится только один спонтанный распад. Да и у изотопов более тяжелых элементов, таких как плутоний и кюрий, спонтанное деление - событие необыкновенно редкое по сравнению с другими видами ядерных превращений.
Удивительной оказалась и энергетика этого изотопа. Удельную мощность калифорниевого источника трудно назвать иначе, как гигантской, - 10 000 квт/кг!
В 1950 году известные американские ученые Стэнли Томпсон, Генри Стрит, Альберт Гиорсо и Гленн Сиборг поместили в поток быстрых гелиевых ядер микрограммовую мишень из кюрия-242, пожалуй самого неподходящего для этой цели изотопа элемента №96. У кюрия-242 очень высокая удельная активность, и работать даже с микрограммовыми количествами подобного вещества весьма неприятно. Да и выход 98-го элемента в реакции кюрий+альфа-частица ожидался мизерным. Слишком мало нейтронов в ядре Cm-242, а это всегда ведет к уменьшению КПД реакции: при недостатке ядерных нейтронов шансы на образование новых элементов заметно уменьшаются. Но другого пути не было. В 1950 году увеличить атомный номер облучаемого элемента более чем на два еще не могли: самыми тяжелыми ядерными снарядами тогда были ядра гелия, альфа-частицы. Опыты проводились на 60-дюймовом циклотроне в Беркли с энергией ионов 35 МэВ.
Новый элемент родился в реакции:
Cm242 + He4 -> 98245 + n.
Получили всего несколько тысяч атомов. Их нужно было отделить от кюрия-242, активность которого достигала 1011 распадов в минуту; столько же альфа-частиц рождается в куске урана весом в несколько десятков килограммов.
По предварительным оценкам (основанных на систематике свойств изотопов трансурановых элементов) ожидали, что период полураспада нового изотопа будет около одного часа. Кюриевую мишень растворили, раствор пустили в хроматографическую колонку с катионообменной смолой Дауэкс-50 и стали промывать смолу элюентом - альфа-оксиизобутиратом аммония.
Адсорбированные смолой атомы переходили в элюент и вместе с ним просачивались сквозь смолу. Ожидаемый порядок выхода актиноидов определили заранее, в опытах с лантаноидами. Элемент №98 - аналог диспрозия - вышел из колонки вовремя. Его исследовали: период полураспада 98245 оказался равным 44 минутам. Новый элемент был назван калифорнием.
Известные изотопы калифорния:
Изотоп Атомная масса Период полураспада Вид распада Cf-242 242.06372 3.3 мин. альфа в Cm-238 Cf-243 243.065 11 мин. альфа в Cm-239 Cf-244 244.06599 20 мин. альфа в Cm-240 Cf-245 245.06807 44 мин. альфа в Cm-241 Cf-246 246.06884 36 час. альфа в Cm-242; самопроизв. (0.2%) Cf-247 247.0712 3.11 час. захват электрона в Bk-247 (99.97%) Cf-248 248.07218 334 дн. альфа в Cm-244; самопроизв. (0.013%) Cf-249 249.07485 351 г. альфа в Cm-245; самопроизв. (5.2E-7%) Cf-250 250.07640 13.1 г. альфа в Cm-246; самопроизв. (0.079%) Cf-251 251.079580 898 г. альфа в Cm-247 Cf-252 252.08162 2.64 г. альфа в Cm-248; самопроизв. (3.08%) Cf-253 253.08513 17.8 дн. альфа в Cm-249; бета в Es-253 Cf-254 254.08732 60.5 дн. самопроизв. (> 99%); альфа в Cm-250 (< 1%) Cf-255 255.0910 1.4 час. бета в Es-255Получить весовые количества калифорния в ядерных реакциях с заряженными частицами - задача практически невыполнимая: слишком мал выход этого элемента при слиянии двух атомных ядер. Поэтому калифорний сегодня получают, облучая тяжелые изотопы плутония и кюрия в нейтронных потоках мощных ядерных реакторов, построенных специально для производства трансуранов. Иначе, в обычном котле, накопление калифорния будет происходить слишком медленно. Потребуется десятки лет, чтобы плутоний или кюрий превратились в элемент №98.
На пути плутоний-калифорний в осколки превращаются 9 999 ядер из 10 000. В конечном итоге на один грамм калифорния затрачивается 10 килограммов плутония-239. И все же потери в реакторе в тысячи раз меньше потерь при синтезе калифорния в пучке ускоренных ядер. Изотоп Cf-252 по существу замыкает цепочку плутоний-калифорний. Это ядро слабо взаимодействует с нейтронами, его очень трудно превратить в еще более тяжелые изотопы. Калифорний-252 становится как бы естественным "тупиком" в реакторной цепи превращений плутония. Поэтому в тупике и скапливаются в основном ядра изотопа Cf252, а более легкие изотопы - Cf249, Cf250, Cf251 - получаются в гораздо меньших количествах, хотя и стоят в передыдущих звеньях цепи превращений.
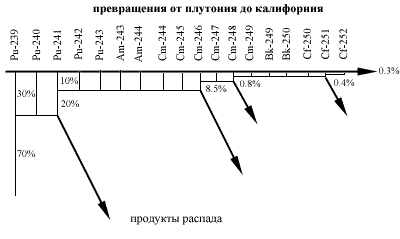
На пути от плутония до калифорния 99.7% всех ядер распадается, и лишь 0.3% пройдут всю цепочку превращений.
Лучше всего изучен и наиболее широко используется изотоп калифорния Cf-252. Калифорний-252 оказался незаменимо полезен для многих физических исследований. Хотя основной вид его распада - альфа-распад, интенсивность параллельного спонтанного деления достаточно велика (3.08%). Микрограмм калифорния-252 в еденицу времени дает столько же ядер-осколков, сколько микрограмм урана при интенсивном облучении нейтронами в ядерном реакторе. Поэтому его применяют для изучения осколков деления.
Главное применение калифорния - изготовление мощных и чрезвычайно компактных источников нейтронов. Грамм калифорния-252 испускает около 3x1012 нейтронов в секунду. Он нашел применение в качестве пусковых источников нейтронов для ядерных реакторов, нейтронного картонажа (определении нефтяных пластов по характеру отражения нейтронов средой).
Калифорний получил известность за свою чрезвычайно малую критическую массу, якобы в "диапазоне грамм", создавая множество спекуляций по поводу возможности создания "карманных" ядерных бомб.
Так же как и у других трансурановых элементов, нечетные изотопы деляться тепловыми нейтронами и имеют наиболее подходящие свойства деления. Только два изотопа подходящие кандидаты на роль делящегося вещества - долгоживущие Cf-249 и Cf-251. Расхожее представление о калифорнии как об оружейном материале обычно сосредотачиваются на Cf-252, вследствии его чрезвычайной нейтронной излучательной способности. Так, число вторичных нейтронов при спонтанном делении у Cf-252 очень велико: в среднем на акт деления приходится 3.82 нейтрона. Известно, что даже незначительная прибавка к числу вторичных нейтронов сильно влияет на критическую массу делящегося вещества, уменьшает ее. Однако относительно маленький период полураспада калифорния-252, интенсивное и проникающее нейтронное излучение, высокая тепловая мощность делают его достаточно непригодным для оружейного использования. К тому же, даже на десяток граммов калифорния придется переработать 100 кг плутония, а это очень много...
На сентябрь 1998 года цена изотопного отделения Ок-Риджской национальной лаборатории (ORNL) на калифорний была такова: $180.25 за микрограмм калифорния-249 и $56.00 за микрограмм калифорния-252.
"Популярная библиотека химических элементов. Радиоактивные элементы Po-(Ns)-...", М. Наука, 1974
На основе материалов Санкт-Петербург. Купить уничтожитель документов по хорошей цене.